
依據國家藥品監督管理局《創新醫療器械特別審查程序》(國家藥監局2018年第83號公告)要求,創新醫療器械審查辦公室組織有關專家對創新醫療器械特別審查申請進行了審查,擬同意以下申請項目進入特別審查程序,現予以公示。

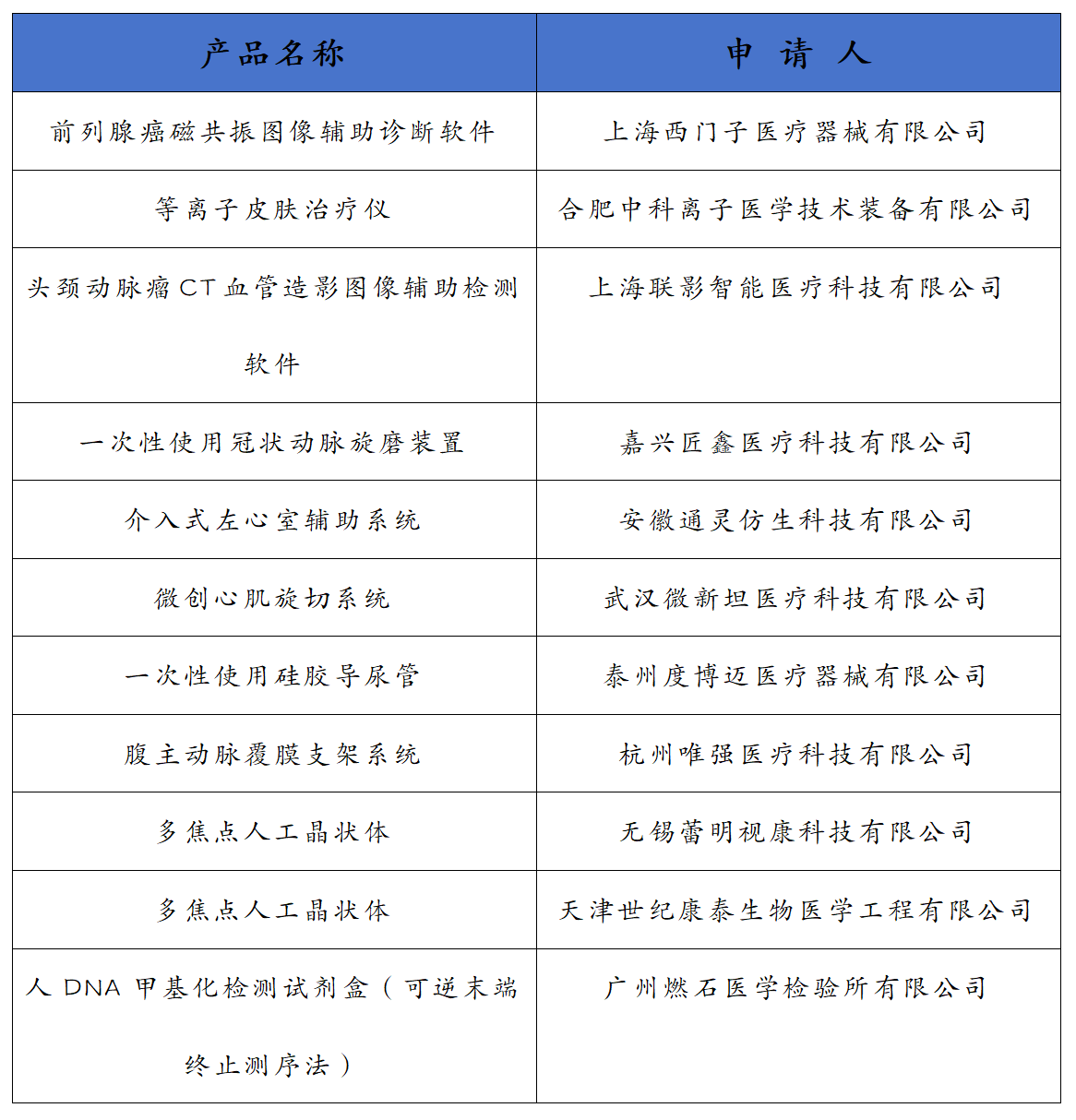
公示時間:2023年9月22日至2023年10月12日 公示期內,任何單位和個人有異議的,可以書面、電話、郵件等方式向我中心綜合業務部反映。
特別說明:進入創新審查程序不代表已認定產品具備可獲準注冊的安全有效性,申請人仍需按照有關要求開展研發及提出注冊申請,藥品監督管理部門及相關技術機構將按照早期介入、專人負責、科學審查的原則,在標準不降低、程序不減少的前提下進行審評審批。國家藥品監督管理局醫療器械技術審評中心2023年9月22日
公司簡介 ★
中科智雅醫療技術集團是一家專注于為大健康領域提供產品注冊,生產質量管理體系,臨床試驗研究與技術輸出全過程的專業服務機構。專注醫療器械技術服務、產品注冊,體系輔導,生產許可注冊服務。
公司被評為中國醫療器械行業協會會員單位,山東省醫療器械行業協會會員,深圳市醫療器械行業協會會員。擁有良好的醫療器械臨床試驗機構合作平臺,暢通的CMDE咨詢服務渠道及優秀的數據管理統計團隊。公司團隊穩定、經驗豐富,醫學相關專業本碩以上學歷人員超過90%,公司先后為國內企業成功提供了千余項專業技術服務,協助(械、健、食、妝、消)企業取得數百張產品注冊證,其中II、III類醫療器械注冊證,IVD試劑產品注冊證,軟件類產品注冊證600多項。
中科智雅醫療秉承:以服務為先、以技術為重的核心價值觀,專一的方向、專業的團隊、專注的態 度獲得廣大醫療器械企業的一致認可。
聯系方式|400-877-6069
公司地址|山東省濟南市槐蔭區西進時代中心B座1014室
|
上一條:醫療器械注冊人、備案人、受托生產企業應該如何落實報告制度?
下一條:這些醫療器械新規,10月份開始實施! |
返回列表 |